IF15.1!南昌大学第一附属医院陈尚祥教授团队获双一区TOP刊!基础模型引导半监督学习破解肝肿瘤CT标注困境!
- 2026-02-12 13:51:59


各位主任院长杰青,大家好呀!
今天小编分享的这篇文章是2025年12月29日在期刊《Npj Digital Medicine》(医学一区,IF=15.1)上发表题为:
“Foundation model-guided multi-view semi-supervised CT segmentation of liver tumors inresource-constrained settings”
这篇文章探讨了在标注数据稀缺的临床环境下,如何通过基础模型引导的多视角协同学习实现肝脏肿瘤CT影像的精准自动分割。旨在解决传统分割方法对大量标注数据的依赖问题,通过融合三维空间信息与半监督学习机制,为肝癌诊断和治疗规划提供高效可靠的技术支持。


中文标题:基础模型引导的资源受限环境下肝脏肿瘤多视图半监督CT分割
发表期刊:Npj Digital Medicine
发表时间:2025年12月29日
影响因子:15.1/Q1

GBD数据挖掘没头绪?多组学课题卡壳?
CHARLS数据不会整合分析?
想复刻高分文章?
关注 + 后台咨询
手把手教你数据挖掘+操作指南!
解锁同款分析套路!

肝脏恶性肿瘤是全球癌症主要死因,增强CT是临床评估金标准。传统深度学习模型依赖大量标注数据,而医学标注成本高昂。基础模型虽缓解数据稀缺问题,但其依赖人工提示且忽视三维空间连续性,限制了全自动分割的临床应用。本研究旨在突破这一瓶颈。


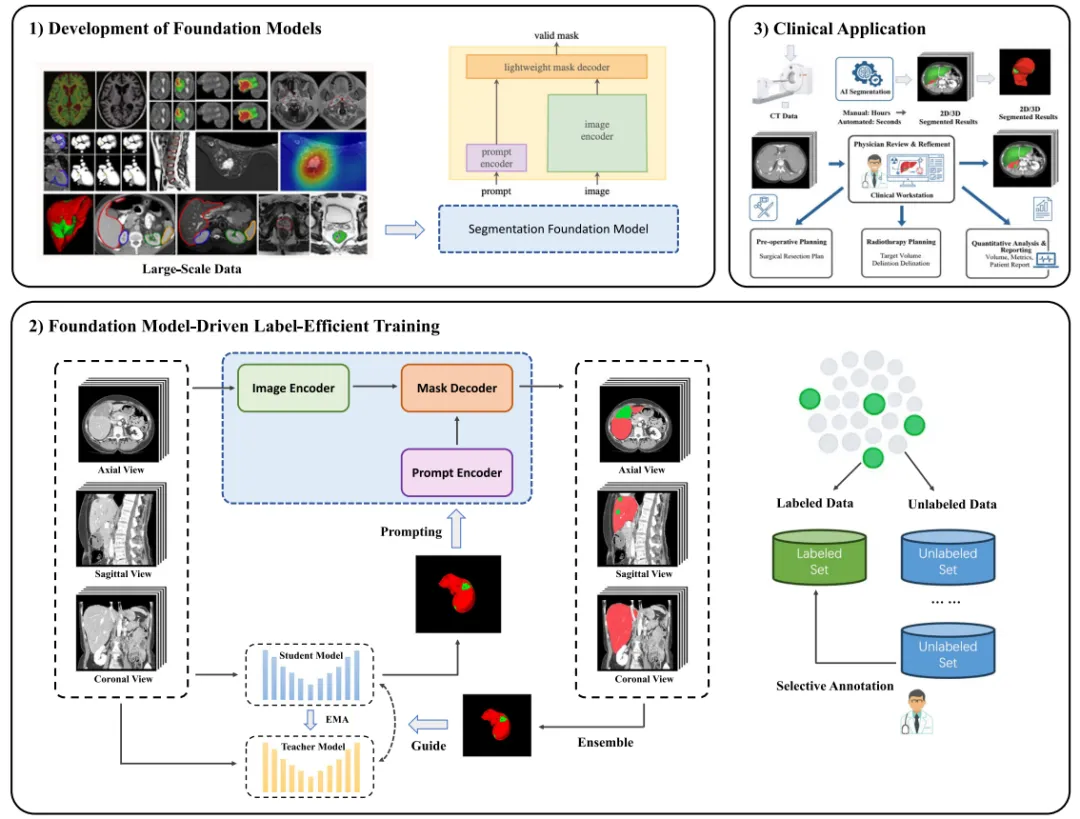
图1.研究框架概述
1️⃣数据来源:采用公开LiTS数据集,包含多中心CT扫描,划分100例训练、33例验证,标注样本数设为1/3/5/10/20模拟稀缺场景。
2️⃣模型设计:以3D U-Net为骨干,结合均值教师框架与SAM-Med3D基础模型,通过多视角(轴状、冠状、矢状面)协同学习融合空间信息。
3️⃣训练策略:利用基础模型生成高质量伪标签,通过Dice损失与交叉熵损失优化模型,减少对人工标注的依赖。
4️⃣评估指标:综合Dice系数、Jaccard指数、ASD和95HD量化区域重叠与边界误差。


研究思路
1️⃣核心问题:解决标注稀缺下全自动分割的挑战,避免基础模型对人工提示的依赖。
2️⃣创新点:将基础模型先验作为正则化器,通过多视角推理抑制单视角噪声,提升三维一致性。
3️⃣技术路径:训练阶段集成基础模型知识,推理阶段仅调用轻量模型,实现高效部署。
4️⃣应用目标:平衡精度与计算成本,满足资源受限临床场景需求。


标注效率分析
通过箱形图和小提琴图分析表明,本文方法在极端标注稀缺场景(1-5样本)下Dice值分布更集中、波动更小,展现出优异的稳定性和可靠性。随着标注数据增加,其性能提升曲线显著优于传统方法,证明能高效利用有限标注信息,在低资源环境中实现稳健分割性能(图2)。
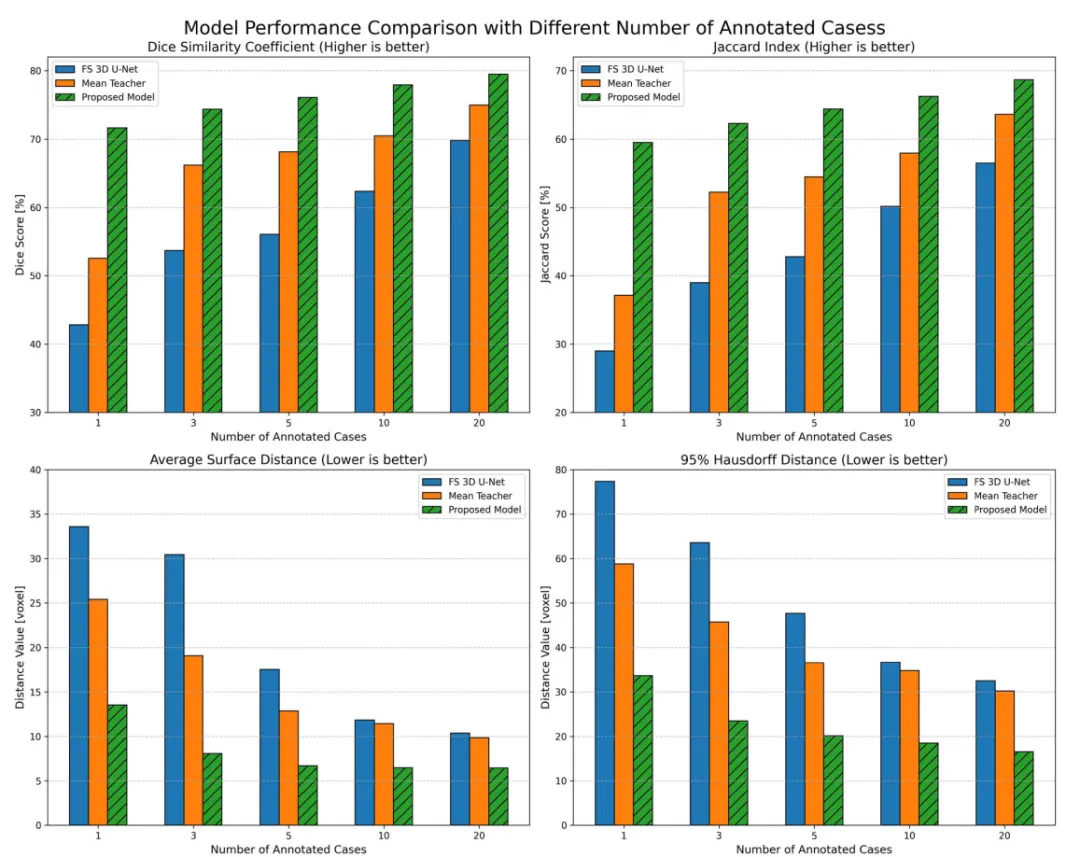
图2.不同分割模型在不同数量的标注案例下不同评估指标的性能比较
视觉对比验证了本文方法在分割质量上的显著优势,有效避免了传统方法的过度分割、小肿瘤漏检等错误。其生成结果与金标准高度一致,边界清晰度和解剖结构保持优异,为临床手术规划和疗效评估提供了可靠依据(图3)。
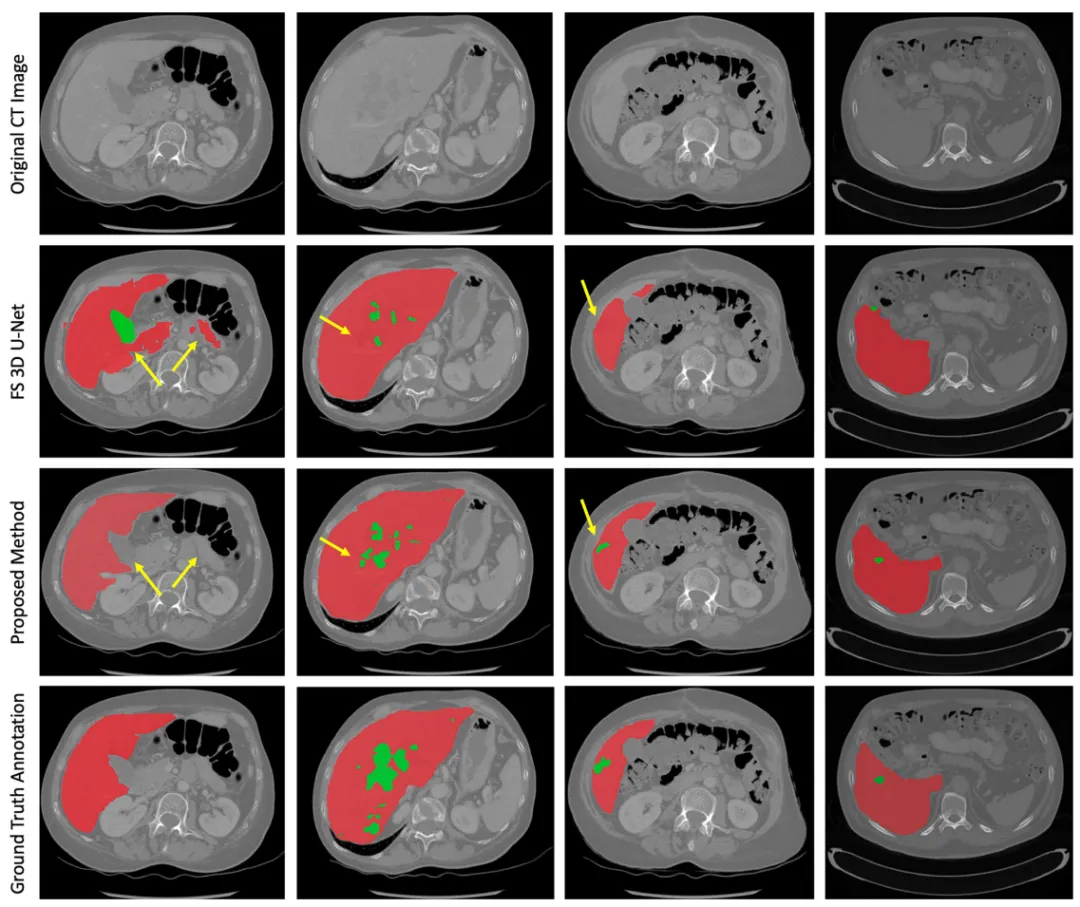
图3.代表性案例的可视化分析
三维重建结果的对比验证了方法在体积空间中的连续性保持能力。左侧金标准与右侧预测结果的高度吻合,不仅体现在整体形状的准确性上,更表现在细小结构的完整保留方面。肿瘤结节的空间定位精确,体积计算与真实值高度一致,这为术前规划和定量评估提供了可靠的三维数据基础(图4)。
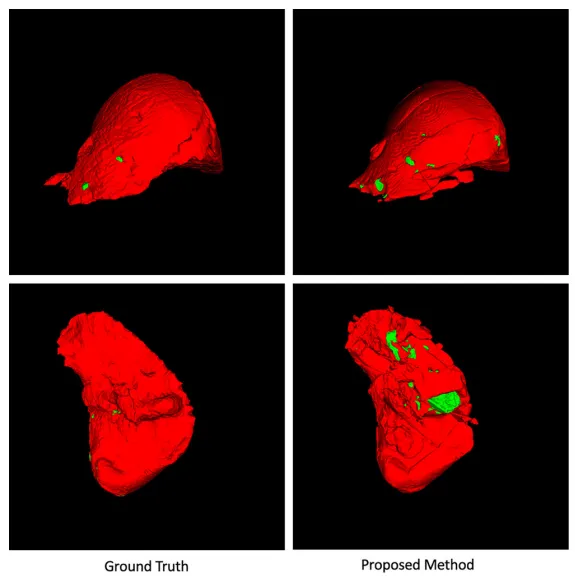
图4.所提方法与真实体数据的3D重建结果的可视化对比
基础模型架构
SAM-Med3D的纯三维架构设计为其在体积数据处理中的优越性能奠定了基础。图像编码器的patch嵌入机制与三维位置编码的结合,确保了空间信息的有效捕获。提示编码器对稀疏和密集提示的处理能力,以及掩码解码器的特征融合机制,共同构成了高质量的伪标签生成基础,为任务专用模型的训练提供了可靠的监督信号(图5)。
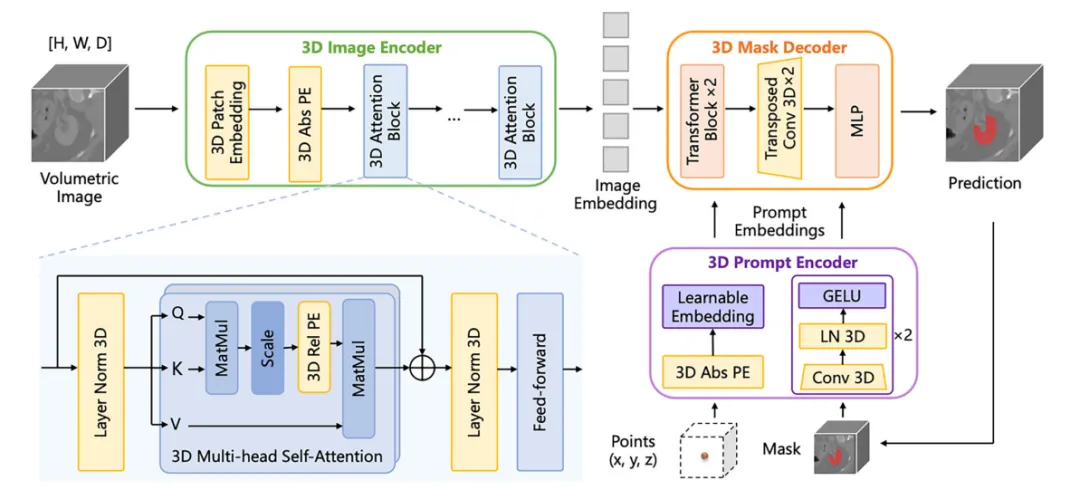
图5.研究中使用的3D分割基础模型SAM-Med3D28的网络架构概述
训练框架机理
该框架通过学生-教师网络的协同训练机制,在标注稀缺情况下有效利用了未标注数据。指数移动平均的权重更新策略确保了教师网络输出的稳定性,而一致性损失函数的设计则促进了模型对数据增强的鲁棒性。这一框架为基础模型的知识迁移提供了适宜的训练环境,是方法成功的关键因素之一(图6)。
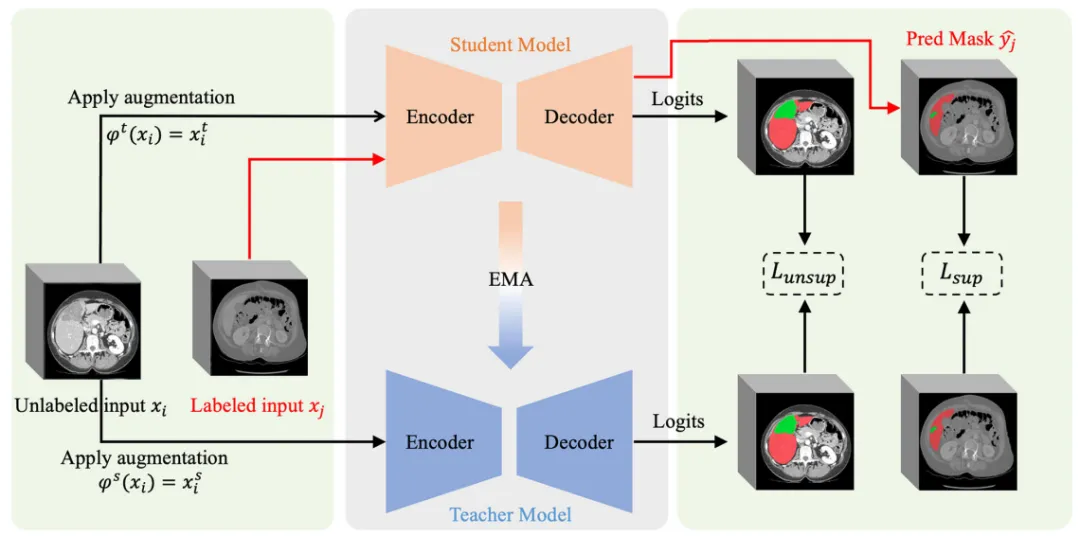
图6.研究中使用的骨干半监督分割框架Mean Teacher32的概述

本研究通过基础模型驱动与多视角协同学习,实现了标注高效、全自动的肝脏肿瘤分割,在极低标注数据下仍保持优异性能。其轻量化设计契合临床资源限制,为肝癌诊断、手术规划及疗效评估提供了可靠工具,推动影像辅助系统向精准医疗迈进。




IF15.1!上海第六人民医院李跃华教授等团队多中心基准研究:大语言模型在脑部MRI报告诊断印象生成中的性能评估!

