南昌大学万昊教授课题组在益生菌与益生元复合体构建及其应用方面取得系列进展
- 2026-02-10 23:55:12

(请点击图片查看)
南昌大学万昊教授课题组在益生菌与益生元复合体构建及其应用方面取得系列进展
近期,南昌大学食品学院副院长万昊教授在益生菌和益生元复合体构建及其应用领域取得了系列进展:
研究背景
免疫稳态与疾病之间复杂的相互作用,驱动着数十年来免疫增强剂的研发,以用于疾病的预防与治疗。免疫增强剂是指能够刺激或增强免疫系统活性的物质,从而强化机体抵疾病的能力。根据来源,免疫增强剂通常可分为合成免疫增强剂和天然免疫增强剂两大类。合成免疫增强剂包括细胞因子类似物、Toll样受体(TLR)激动剂、CpG寡核苷酸以及各种基于聚合物或纳米颗粒的佐剂等。这些制剂在现代临床实践中得到了广泛应用,特别是作为疫苗佐剂以增强抗原特异性免疫,或在癌症免疫治疗中用于增强抗肿瘤反应或改善免疫检查点抑制疗效。尽管其免疫调节效果强大,合成增强剂常面临显著的局限性,如组织毒性积累、不必要的炎症反应,以及可能导致长期免疫功能障碍等问题。此外,合成免疫增强剂通常需要通过注射给药并在医疗监督下使用,这可能限制其在常规或长期使用中的适用性。相比之下,来源于食物、植物、真菌或动物的天然免疫增强剂通常被认为更加安全,并且作为提升不同人群免疫功能的潜力策略,近年来得到了越来越多的关注。例如,β-葡聚糖被报道可作为癌症治疗和免疫营养的佐剂,香菇多糖可作为辅助抗癌的免疫调节剂,皂苷(如QS-21)已在批准的疫苗中得到应用,而大蒜来源的纳米颗粒(GNPs)则因其优异的生物相容性,能够增强免疫检查点抑制疗法的效果。这些天然免疫增强剂优越的生物相容性及其口服给药的适用性与患者的需求和日常生活方式高度契合,使其不仅在治疗干预方面具有吸引力,也适合纳入日常健康维护。尽管天然免疫增强剂在安全性和患者依从性方面具有明显优势,但其疗效常存在较大差异,且与合成免疫增强剂相比效力较弱。这一问题凸显了进一步开展研究和创新的必要性,亟需通过结构修饰、协同配方或联合疗法等手段优化其疗效,从而扩展其临床应用范围,提升其在临床治疗中的实际价值。
现有研究表明,益生菌,特别是植物乳杆菌(Lactobacillus plantarum,LP),在增强机体免疫力方面具有显著的免疫调节作用。然而,由于益生菌对胃肠道应激(如胃酸和胆汁盐)高度敏感,单独使用益生菌难以通过免疫调节提供充分的疾病治疗或预防效果。因此,保护益生菌免受胃肠道环境影响的封装方法,如单细胞包被和合成聚合物微胶囊封装,已成为研究的热点。选择具有足够保护效能的封装壁材,对于保持口服益生菌的生物活性至关重要。
多糖是各类食物(如蔬菜和水果)中的一类主要活性成分,可被肠道菌群选择性代谢,从而对宿主产生有益作用。一些研究已初步揭示多糖在口服后增强细胞免疫和体液免疫的能力,这使其成为开发口服免疫增强剂的理想候选者。鉴于其固有的聚合物结构,多糖被证实是益生菌口服递送中理想的封装壁材——不仅能提升益生菌的生物利用度,还能通过与益生菌的协同效应,实现更优化的应用潜力。金线莲(Anoectochilus formosanus, A. formosanus)因其食用特性以及在治疗炎症、解毒和缓解咽喉感染等方面的广泛应用,被视为“药食同源”植物。研究表明,金线莲的甲醇提取物可通过降低程序性死亡配体1(PD-L1)的mRNA和蛋白水平,从而抑口腔癌细胞的增。此外,金线莲多糖(AFP)被认为是金线莲中一类具有高生物活性的大分子,表现出免疫刺激和抗肿瘤等多种功能。例如,AFP可通过促进淋巴细胞增殖、增加一氧化氮(NO)生成以及促进细胞因子(IL-2、IL-6和IFN-γ等)的分泌来增强体外脾淋巴细胞的免疫活性。此外,部分研究提AFP具有益生元潜力,可能通过调节免疫来维持肠道免疫力,进而促进人体肠道健康。此前,我们课题组初步发现,金线莲粗多糖混合物在体内外均表现出一定的免疫调节活性。理论上,粗多糖中的某些精制组分可能具备增强机体免疫的潜力。这启发了我们利用利用从金线莲粗多糖中分离得到的精制多糖,为益生菌赋予免疫调节特性。利用这些多糖固有的生物活性、生物相容性和生物可降解性,建立一个生物安全的益生菌口服递送平台,旨在通过利用协同免疫调节效应获得一种有效的口服免疫增强剂。
结论与展望
在此,我们发现并从金线莲中获得了一种天然精制多糖(AFP-80),它意外地显示出免疫刺激特性,且未引起任何可检测的不良反应。AFP-80被应用于在单细胞水平上武装LP,通过我们课题组最近开发的基于Fe³⁺-单宁酸网络(Fe-TA)的桥接策略,通过简单搅拌构建了一种口服免疫增强剂(LP@Fe-TA@AFP-80),用于有效增强宿主免疫力。该口服免疫增强剂的配方方法以其简单快捷为特点(整个过程仅需约15分钟的搅拌),有利于工业转化。此外,由于构建LP@Fe-TA@AFP-80的组分源自食物基来源,该免疫增强剂显示出优异的生物相容性,直接通过连续口服给药(每次1 × 10⁸ CFU/mL,每2天一次)6个月后观察到可忽略的生物毒性得以证实。摄入LP@Fe-TA@AFP-80后,AFP-80作为稳定而坚固的屏障,阻止胃肠道应激攻击LP,之后存活的LP借助Fe-TA(因其通过形成氢键而具有对肠粘膜层的粘附能力)定植于肠道内,从而与AFP-80协同作用以增强免疫力。结果表明,LP@Fe-TA@AFP-80成功增强了免疫低下小鼠的体液/肠道免疫力,恢复了肠道屏障,促进了免疫刺激细胞因子的分泌,并增强了机体的抗氧化能力,其潜在机制被解读为与肠道菌群失调的恢复以及过氧化物酶体增殖物激活受体(PPAR)信号通路激活的参与密切相关。值得注意的是,借助其令人满意的免疫增强效果,LP@Fe-TA@AFP-80还实现了抑制肿瘤生长以及与免疫检查点PD-L1阻断联合根除肿瘤,突显了其作为一种有效肿瘤治疗剂的潜力。鉴于免疫功能在各种疾病发生发展中的关键作用,这种口服免疫增强剂显示出预防和治疗多种疾病的潜力,并且由于其优异的生物相容性,可以融入日常健康方案中。
图文赏析
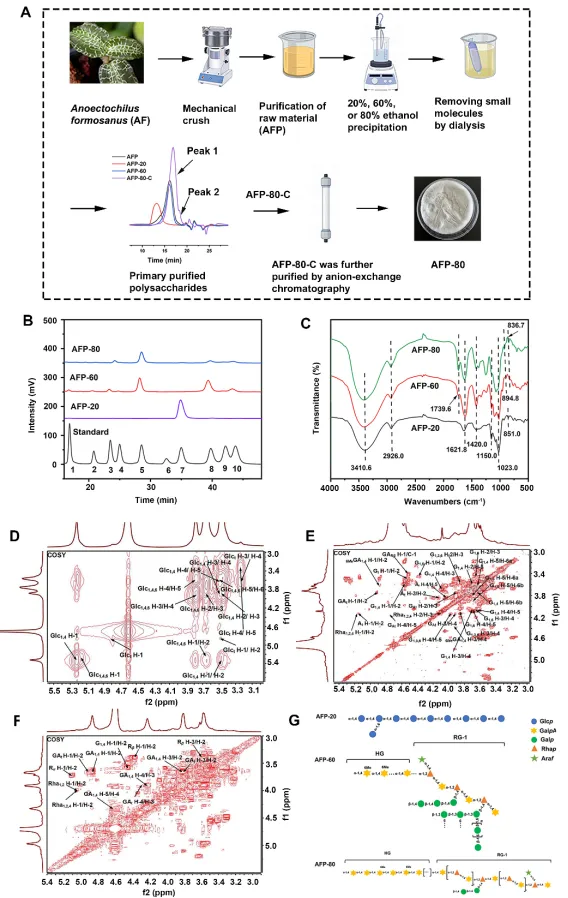
图1 金线莲精制多糖的提取、纯化和表征
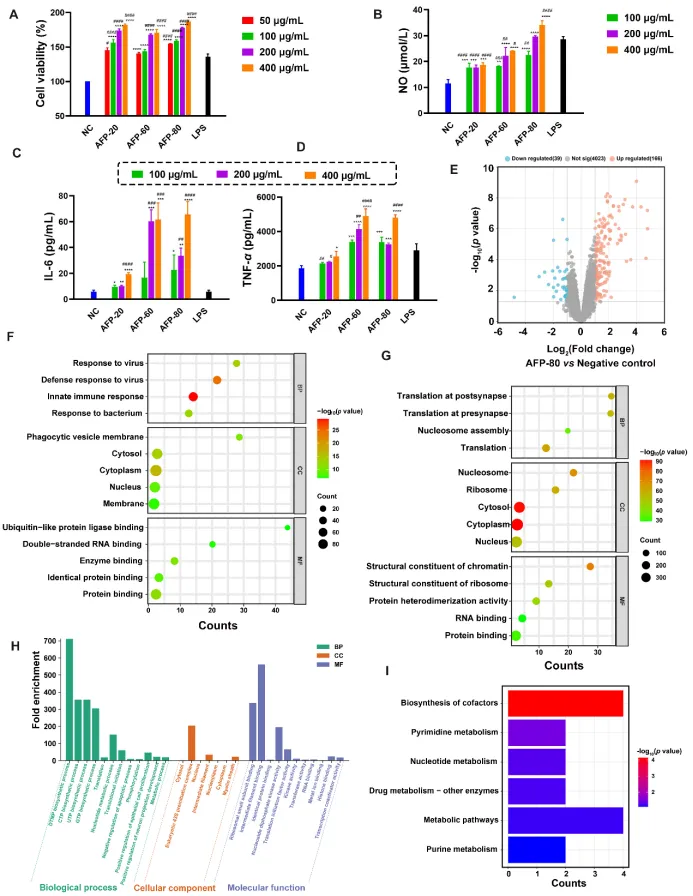
图2 金线莲精制多糖对巨噬细胞RAW264.7的免疫激活能力评价
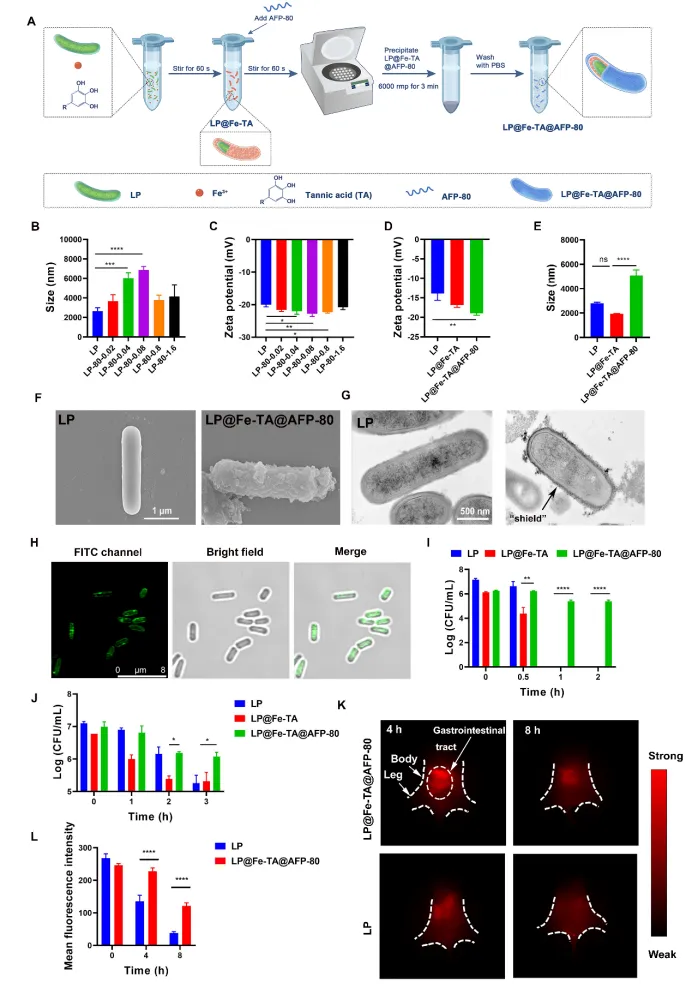
图3 LP@Fe-TA@AFP-80对胃肠道应激的耐受性及肠道定植能力评价
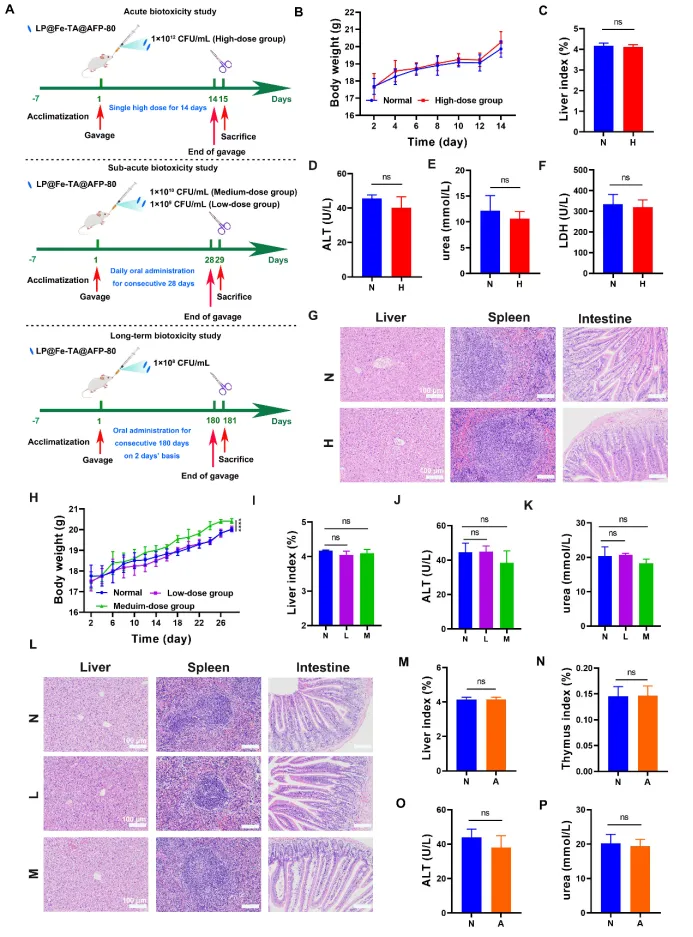
图4 LP@Fe-TA@AFP-80的生物相容性评价
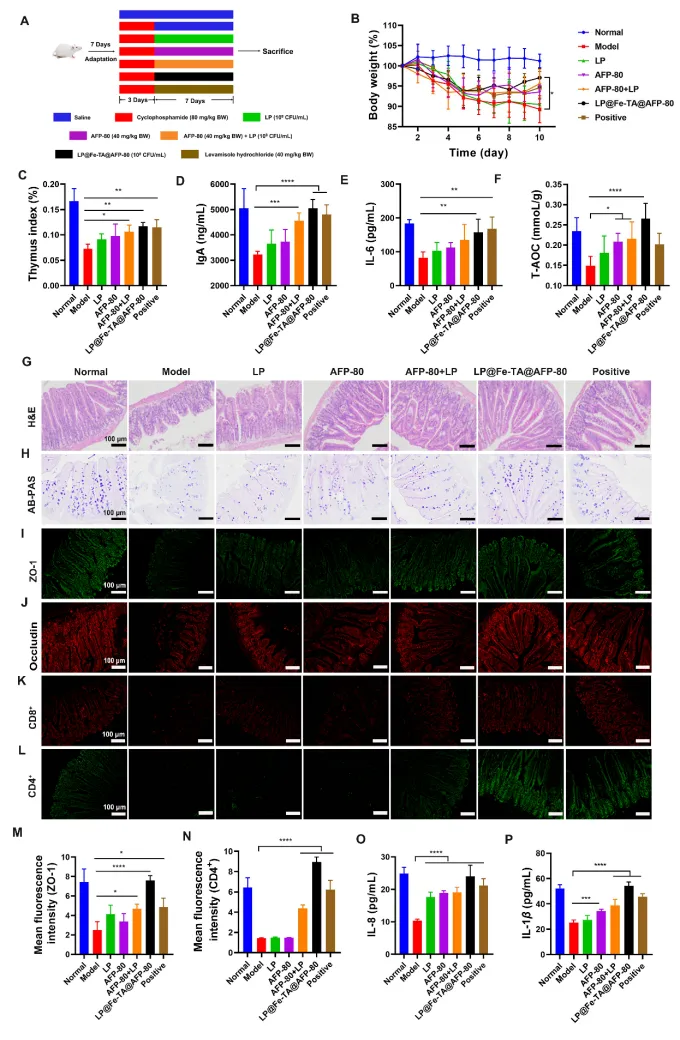
图5 LP@Fe-TA@AFP-80对免疫功能低下小鼠的免疫调节作用
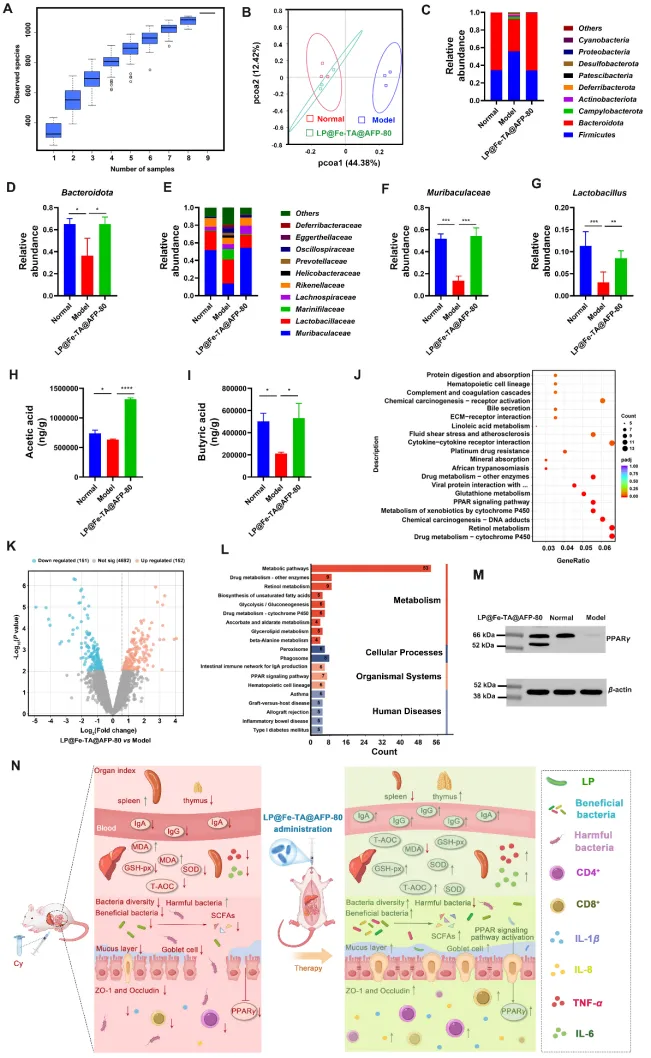
图6 LP@Fe-TA@AFP-80增强免疫的潜在机制
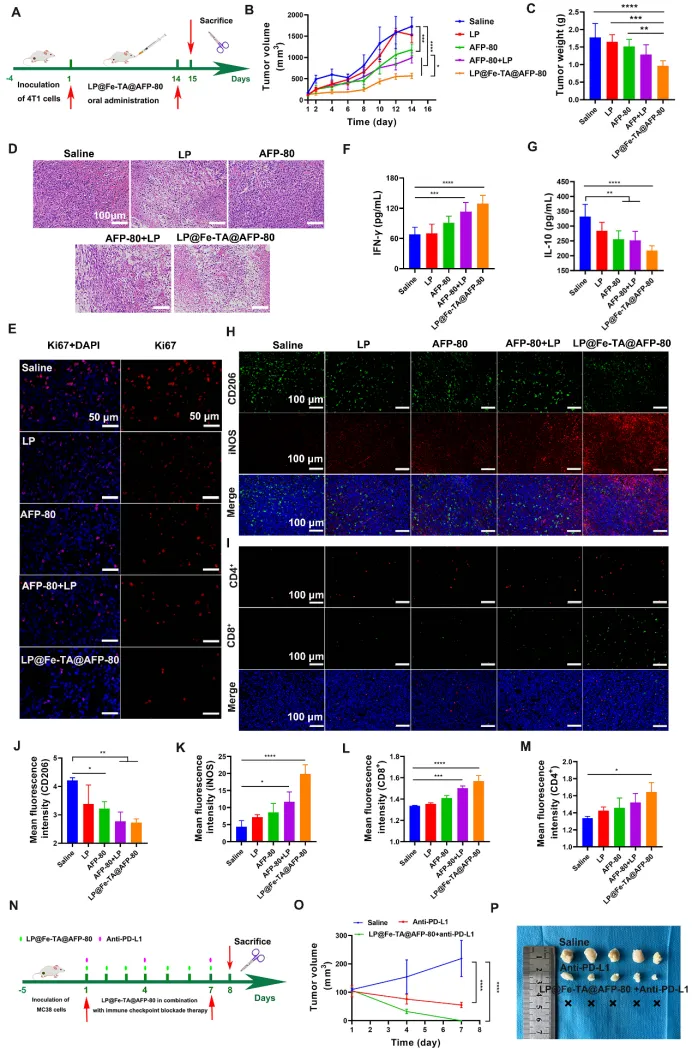
图7 LP@Fe-TA@AFP-80的抗肿瘤活性
文章二:万昊教授课题组在The Innovation Materials期刊发表题目为在The Innovation Materials期刊发表题目为“Probiotic-based biohybrid with gastrointestinal stress resistance and ROS-scavenging capacity to treat inflammatory bowel disease”的研究性论文。本文第一作者为南昌大学食品学院博士生陈晓敏,万昊教授为通讯作者。文章设计了一种新型“生物杂交体”,犹如为益生菌披上“智能盔甲”。该设计不仅能保护益生菌精准抵达肠道,还能主动清除有害活性氧,从而协同修复肠道。动物实验表明,此策略对两种IBD模型均具有卓越疗效。本研究不仅提供了一种有前景的新疗法,也为治疗其他复杂胃肠道疾病提供了一个通用的技术平台。
炎症性肠病(IBD)是一种严重的胃肠道疾病,主要分为两种亚型:溃疡性结肠炎(UC)和克罗恩病(CD)。目前IBD的药物治疗主要包括氨基水杨酸盐、皮质类固醇和免疫调节剂。然而,并非所有患者对这些治疗均有有效反应,且长期使用可能引起严重不良反应。此外,由于UC和CD具有不同的病理特征,大多数现有治疗方法主要针对其中一种亚型,能同时对两种亚型均持续有效的治疗策略有限。开发一种广泛有效的策略虽然具有挑战性,但通过靶向IBD共同的病理生理学机制是可行的。IBD的核心病理生理驱动因素包括氧化应激、免疫失调和肠道微生物菌群失调。因此,针对这些共同病理特征的治疗策略有望同时应对UC和CD。
口服益生菌疗法因其天然来源、安全性和易于给药而成为IBD治疗的一个引人注目的选择。关键在于,益生菌能够独特地恢复肠道菌群平衡,这是IBD病理学的核心方面,而大多数其他疗法无法直接解决此问题。益生菌调节代谢物产生、竞争性抑制病原体和调节免疫反应的能力,使其成为治疗UC和CD的一种综合性替代方案。然而,口服益生菌在IBD治疗中面临重大挑战。一方面,严酷的胃肠道应激(如胃酸和胆汁盐)会降低益生菌的存活率。另一方面,炎症肠道环境中升高的活性氧(ROS)构成了另一个常被忽视的应激源,可能损害益生菌的存活和功能。这些障碍阻碍了口服益生菌疗法的临床应用,凸显了技术创新的必要性。
为了解决这些问题,封装技术已成为一种有前景的策略。在各种封装基质中,β-葡聚糖(GN)——一种FDA批准的多糖——显示出保护益生菌的潜力。其聚合物结构可提供类似于Eudragit L100-55等合成聚合物的物理屏障。此外,GN具有生物相容性、胃肠道稳定性以及固有的益生元特性。其益生元特性使其能够被肠道菌群选择性代谢,从而促进益生菌的靶向释放,同时促进短链脂肪酸(SCFAs)的产生,这可能协同缓解炎症。这些特性使GN成为IBD口服益生菌递送的一种理想封装基质。为了将GN包裹在益生菌上,我们将注意力转向单细胞封装技术,以实现精确的个体化保护。虽然非共价相互作用提供基础保护,但共价锚定可以增强结构稳定性。然而,传统的化学方法由于与活体益生菌不兼容,限制了单细胞共价封装的应用。生物正交化学提供了一个强大的替代方案,它能够在活体益生菌表面进行位点特异性官能团引入,而不影响其活性,并通过像无铜点击化学这样生物相容的反应实现高选择性的共价连接。
除了损害益生菌功能外,IBD中过量的ROS还会通过氧化应激加重组织损伤,这使得ROS清除成为另一个关键的治疗目标。纳米酶(具有类酶活性的纳米材料)的最新进展已显示出强大的ROS中和潜力³⁵。其中,金纳米簇(AuNCs)以其优异的生物相容性、稳定性和广谱催化活性而备受关注。我们课题组先前开发了Au24M1,这是一种通过将Au25簇中的一个Au原子替换为一个过渡金属原子(Cu或Cd)而设计的AuNC。这种原子级的精确调控增强了其超氧化物歧化酶(SOD)和过氧化氢酶(CAT)样活性。因此我们假设,将Au24M1与益生菌共同递送可以减少炎症微环境中的ROS,保护益生菌活力,并中和氧化应激,从而协同改善IBD治疗。
我们合理设计了一种基于益生菌的生物杂合体(Lp@AU@GN)。该生物杂合体采用生物正交技术构建,其特点是具有锚定在Lp上的活性氧清除纳米酶(AU)以及共价连接的多糖基益生元保护层(即GN)。每个组分都发挥着独特而互补的作用。具体而言,口服给药后,GN保护Lp免受严酷的胃肠道环境侵害。到达肠道后,GN被肠道菌群选择性代谢为短链脂肪酸(乙酸、丙酸、丁酸和戊酸),这不仅有助于对抗IBD,还触发了Lp@AU的靶向释放。这种靶向释放是一个关键优势,确保在炎症部位最大化治疗效果,同时最小化脱靶暴露。在此过程中,AU介导的活性氧清除起到了保护宿主肠道和益生菌免受氧化损伤的作用,从而提高了Lp的活力并增强了其治疗效能。在DSS诱导的溃疡性结肠炎小鼠模型中进行的体内评估证实了Lp@AU@GN的优越性能。口服给药在减轻体重下降、降低疾病活动指数、恢复结肠长度、使脾脏指数正常化以及恢复上皮屏障完整性方面,均显示出优于其他制剂(Lp、AU@GN或Lp@AU)的效果。这种全面的验证直接证明了整合产生的协同效应大于各部分的简单相加,而这一论断在常规研究中常常缺失。从机制上讲,Lp@AU@GN降低了活性氧水平,抑制了促炎细胞因子,并上调了抗炎细胞因子。重要的是,它恢复了肠道菌群平衡。尤其上调了与多糖代谢相关的拟杆菌目相关细菌,这支持了GN的整合作用并表明了代谢益处。这些发现导致治疗后的UC小鼠体内短链脂肪酸水平升高,进一步推进了治疗效果。该生物杂合体能够同时调节氧化应激、免疫功能障碍和微生物菌群失调,这使其有别于以往仅关注其中一两个方面干预措施。
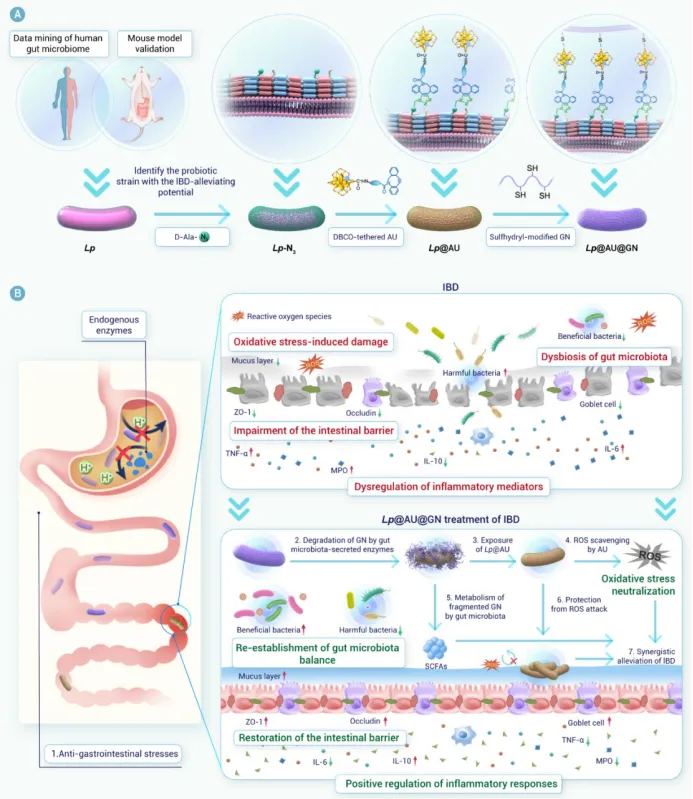
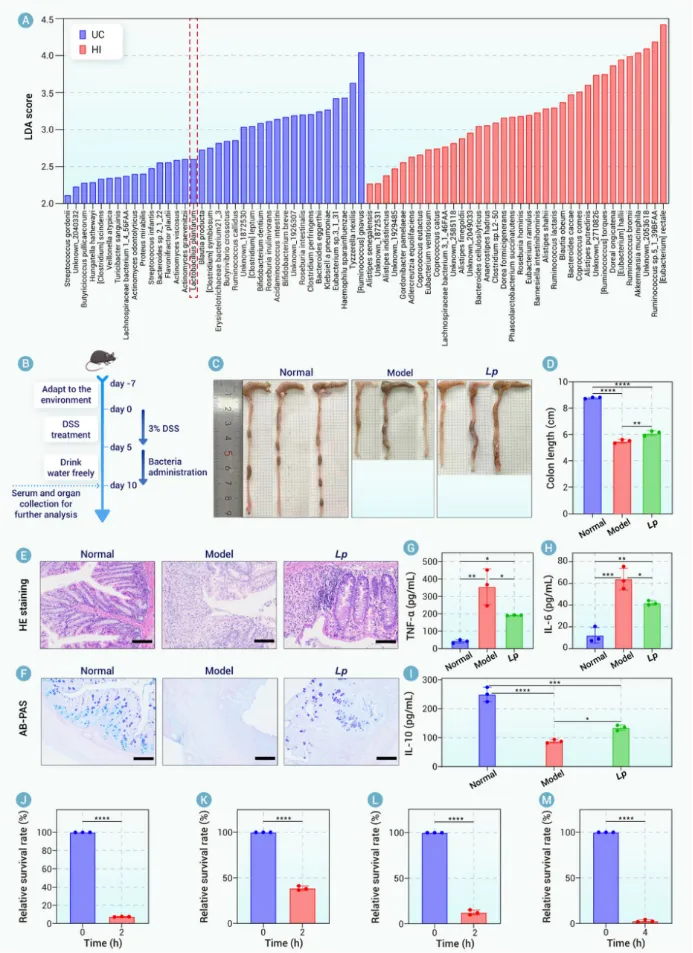
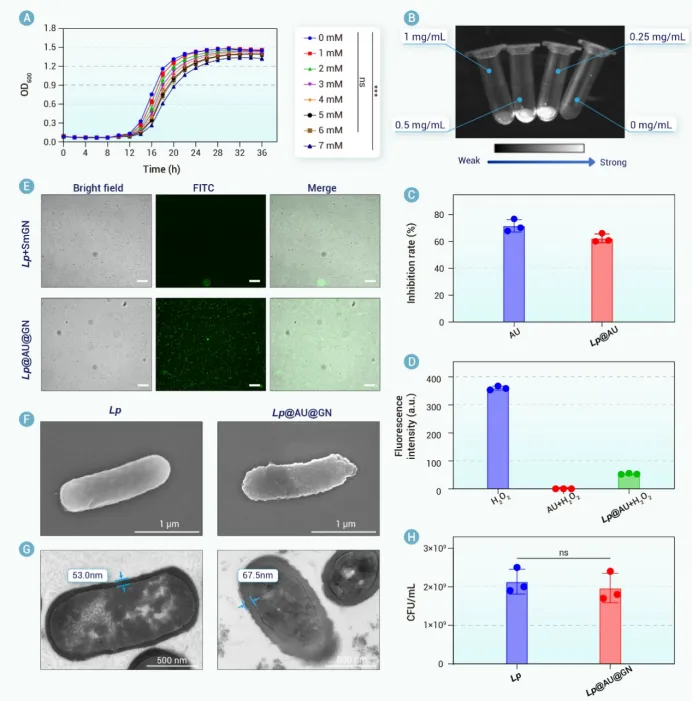
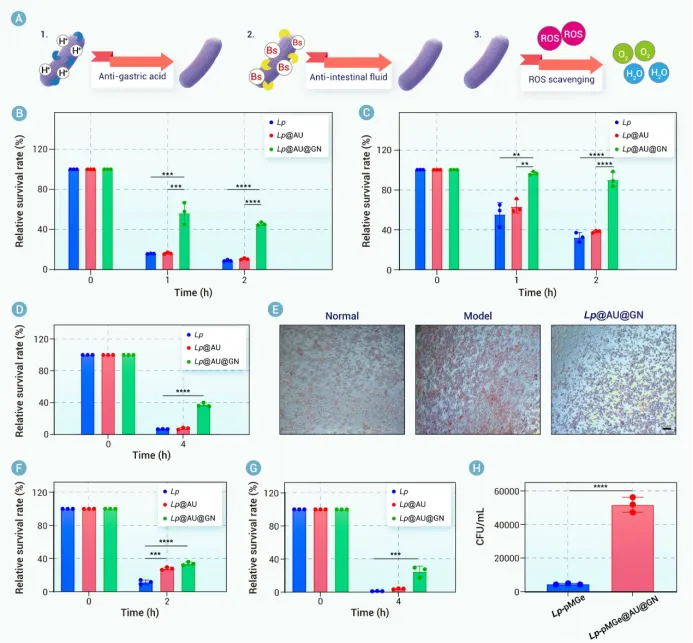
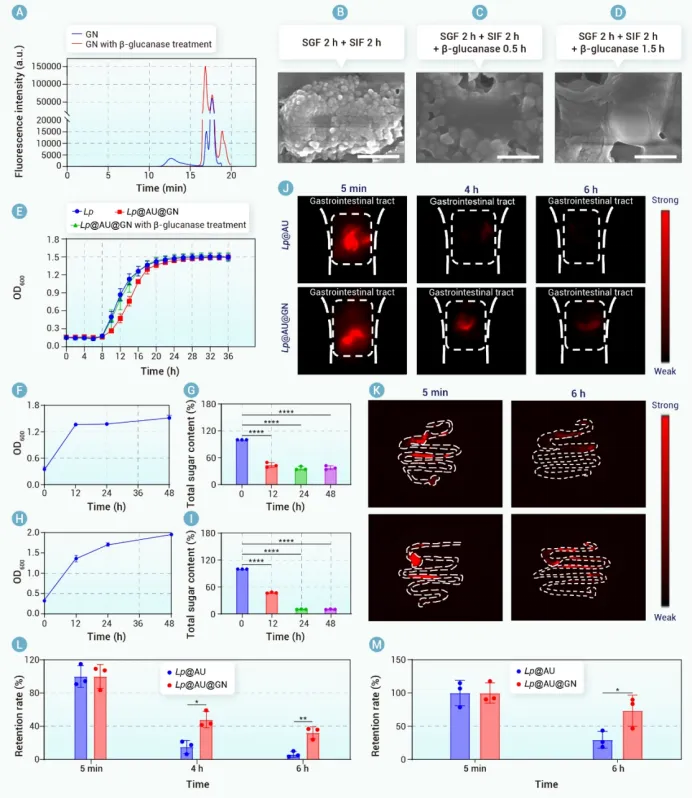
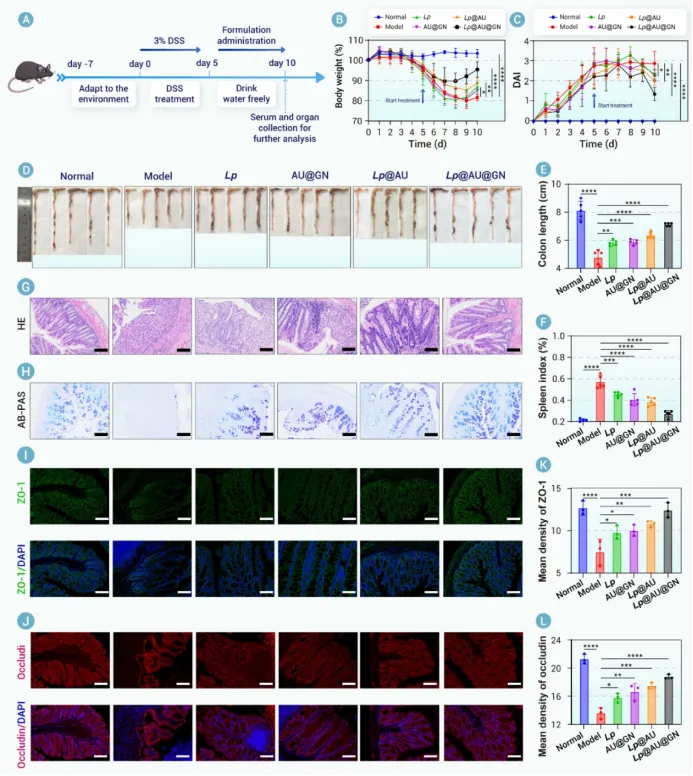
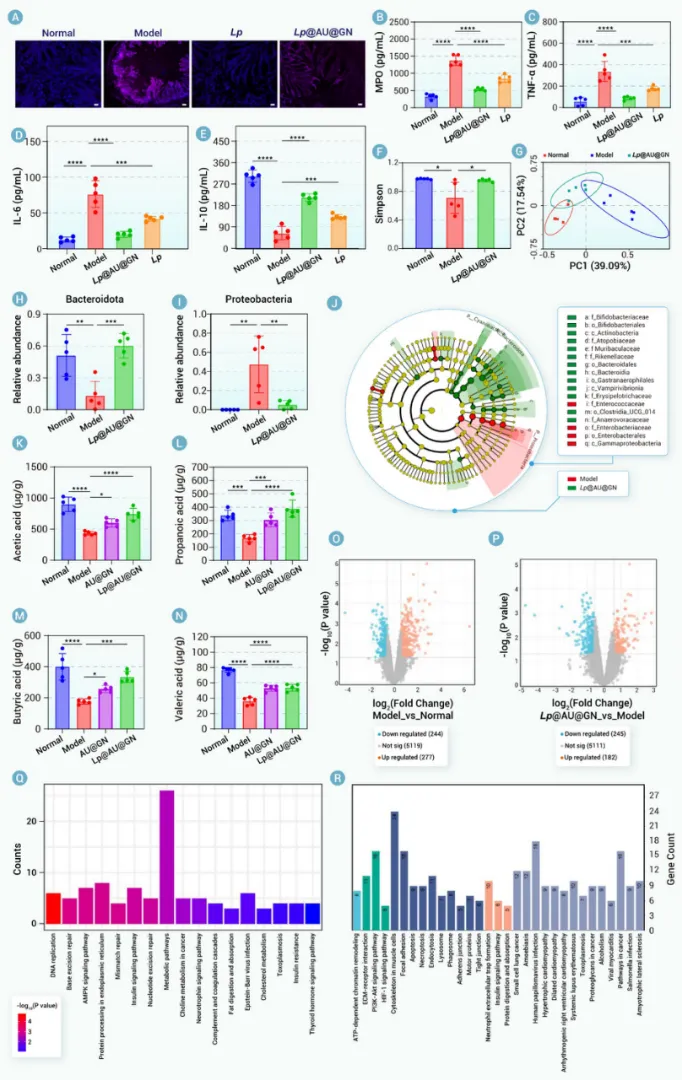
图7. Lp@AU@GN治疗UC的机制研究。
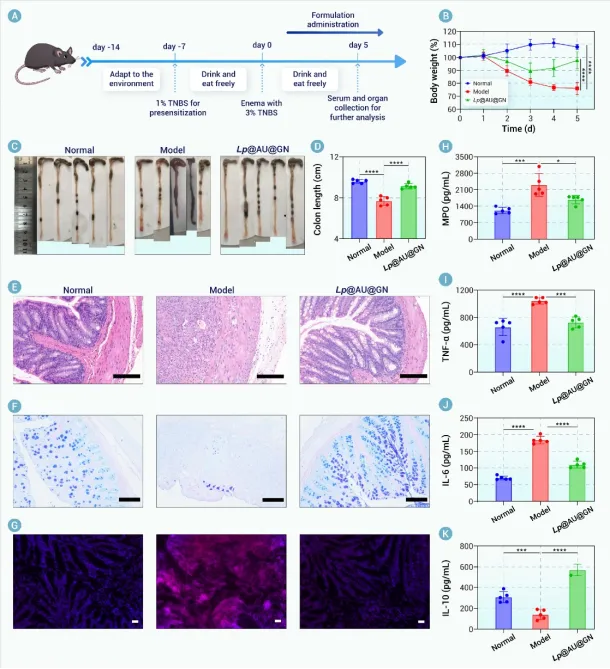
图8. Lp@AU@GN在TNBS诱导的CD模型中的疗效评估。
文章三:万昊教授课题组在Biomaterials期刊发表题目为在Hierarchical arming of probiotics for improved viability to synergistically alleviate ulcerative colitis的研究性论文。本文第一作者为南昌大学食品学院硕士生刘祖薇,万昊教授为通讯作者。本研究提出了一种创新的“分层防护”策略,显著提升了益生菌在胃肠道恶劣环境中的生存率,并增强了其治疗效果。这项研究,针对益生菌在治疗溃疡性结肠炎(UC)过程中面临的挑战,开发出了一种结合单细胞涂层与微胶囊化的创新方法,取得了显著疗效。
溃疡性结肠炎(UC)是炎症性肠病(IBD)的一种类型,具有高复发率和慢性病程,且与结直肠癌的风险增加密切相关。UC的传统治疗方法,如类固醇、免疫抑制剂和生物制剂,虽然有效,但常伴随副作用和患者依从性差的问题。因此,迫切需要寻找新的、更安全的治疗方法。近年来,益生菌因其能够调节肠道菌群、增强肠道屏障功能、抑制病原菌生长以及调节免疫反应等特点,成为治疗UC的潜力方案。然而,益生菌在胃肠道内容易受到胃酸、胆盐和肠道蠕动等不利因素的影响,导致其在到达肠道之前大部分失活,从而削弱其治疗效果。与此同时,益生菌在存储和加工过程中也容易失去活性,这进一步限制了其在临床应用中的普及。
为了解决这些问题,我们提出了益生菌保护策略,如单细胞涂层和微胶囊化方法,以增加益生菌在胃肠道中的生存率和稳定性。然而,现有的保护方法仍面临效果有限的挑战,亟需新的更有效的解决方案。因此,本研究提出了一种结合单细胞涂层与微胶囊化技术的层级武装策略,通过为益生菌提供双重保护,进一步提升其生存能力和疗效。
具体而言,我们选用了Lactobacillus reuteri (Lr),一种具有显著肠道健康益处的益生菌,并对其进行了层级武装处理。首先,采用生物正交化学方法,将β-葡聚糖(GN)通过点击化学反应涂覆在Lr的细胞表面,形成Lr@GN。接着,Lr@GN进一步通过转谷氨酰胺酶(TGase)催化交联,包覆上一层由大豆蛋白分离物(SPI)构成的三维网络,最终形成Lr@GN@SPI复合物。该层级武装系统在胃肠道环境中提供了强大的物理屏障,有效防止了益生菌在运输过程中的失活。
这一层级武装系统的创新之处在于,GN涂层可以帮助益生菌抵抗胃酸等恶劣环境,SPI微胶囊则通过物理包覆进一步增强了益生菌的胃肠道耐受性。在到达肠道后,SPI被肠道酶逐步降解,而GN在肠道微生物的作用下转化为短链脂肪酸(SCFAs),这不仅促进了Lr的控释释放,还产生了SCFAs,增强了益生菌的治疗效果。
在此基础上,研究人员发现,Lr@GN@SPI在小鼠模型中表现出卓越的治疗效果,能够通过修复肠道屏障、调节炎症反应和重塑肠道菌群,显著缓解UC症状。实验结果还表明,Lr@GN@SPI通过增加益生菌的肠道生存率和延长其肠道滞留时间,成功恢复了肠道黏膜的完整性,并在免疫细胞因子的调节、肠道菌群的重建等方面起到了重要作用。
本研究表明,Lr@GN@SPI 在溃疡性结肠炎的小鼠模型中具有显著的治疗效果,能够通过恢复肠道屏障、调节炎症反应以及重塑肠道微生物群,缓解UC症状。实验结果还显示,Lr@GN@SPI不仅增强了益生菌的胃肠道耐受性,还通过调节肠道微生物群,使益生菌的益处得到了最大化。进一步的分析显示,Lr@GN@SPI显著降低了促炎细胞因子(如IL-6和TNF-α)的水平,并提高了抗炎细胞因子(如IL-10)的浓度。此外,Lr@GN@SPI还改善了肠道菌群失衡问题,增加了有益细菌(如Bifidobacterium、Clostridium)的相对丰度,减少了有害菌(如Escherichia-Shigella、Enterococcus)。这些结果突显了层级武装策略在益生菌保护和溃疡性结肠炎治疗中的广泛潜力。
展望未来,研究人员计划进一步探索该技术的临床转化可能性,尤其是在其他胃肠道相关疾病中的应用。此外,通过优化微胶囊化和涂层材料的设计,Lr@GN@SPI有望成为治疗溃疡性结肠炎和其他炎症性肠病的新型疗法,为益生菌治疗提供更加安全、有效的解决方案。
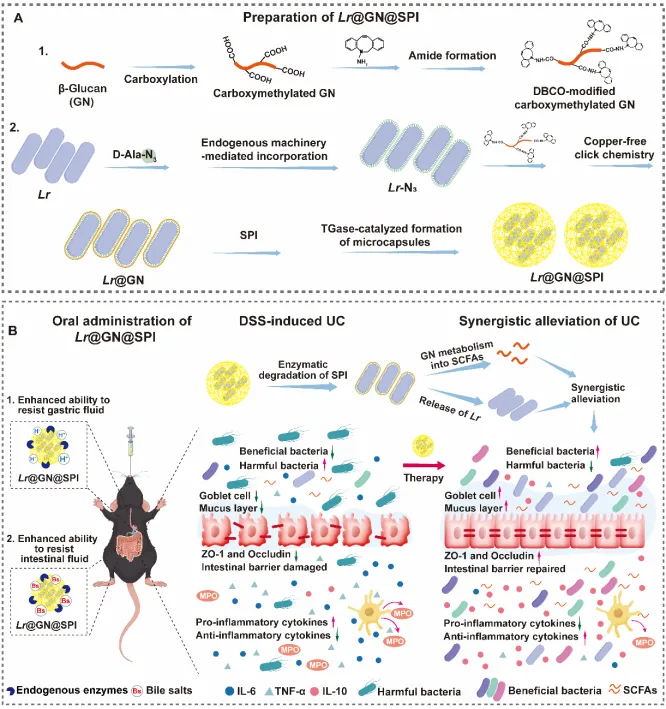
图1 Lr@GN@SPI 的制备及其缓解小鼠DSS 诱导的UC 的流程图
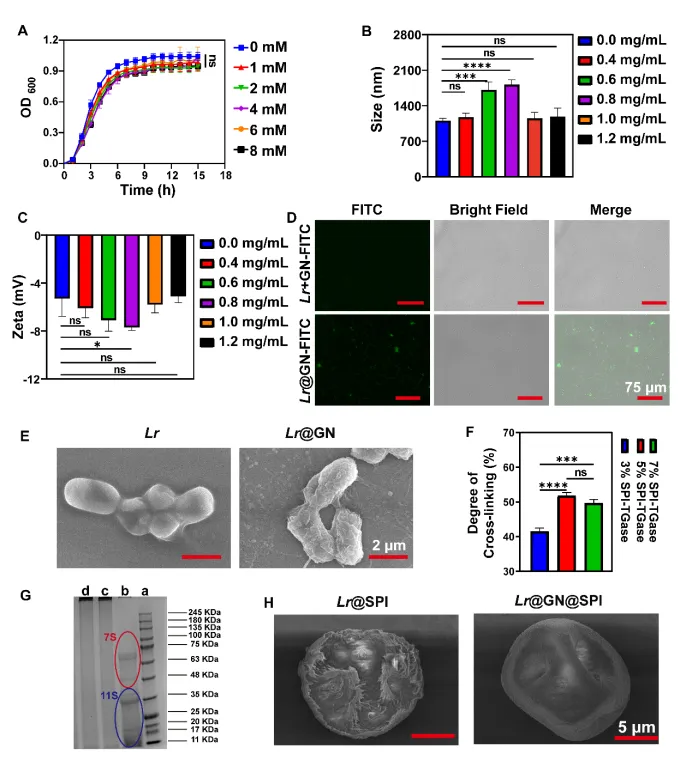
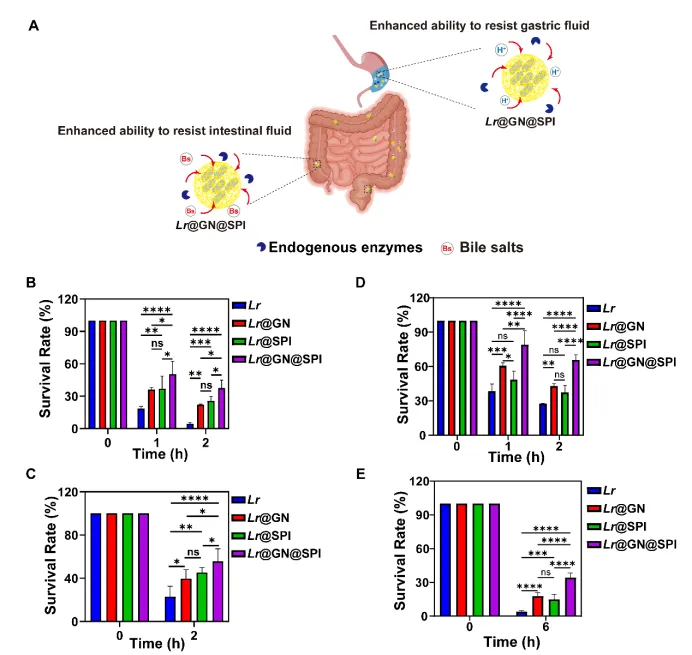
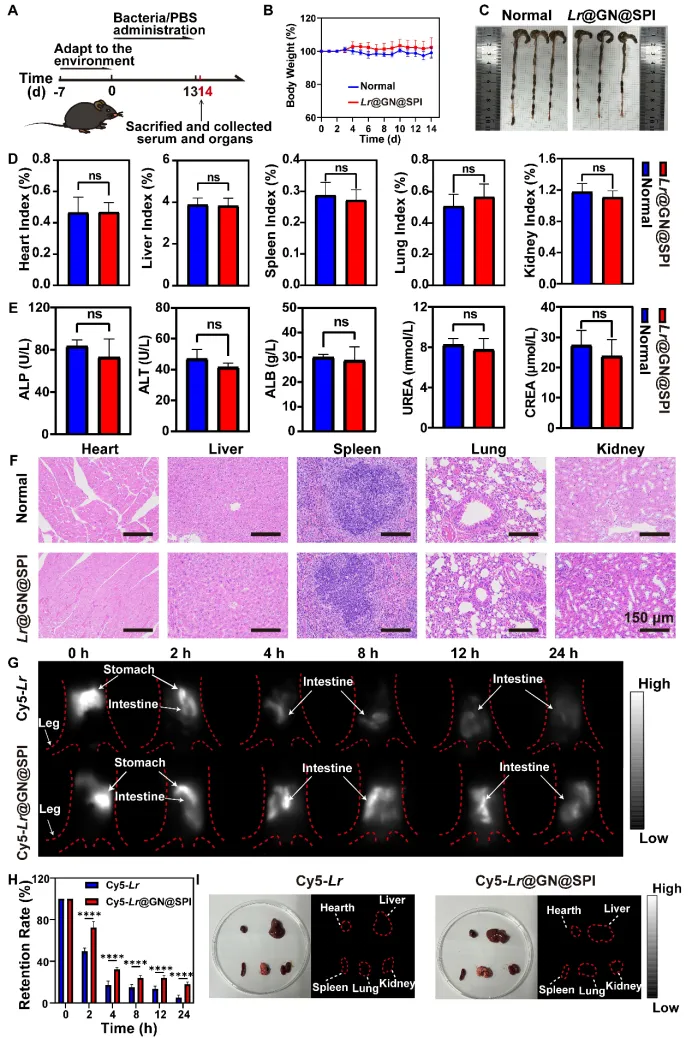
图5 Lr@GN@SPI体内生物相容性和肠道滞留率
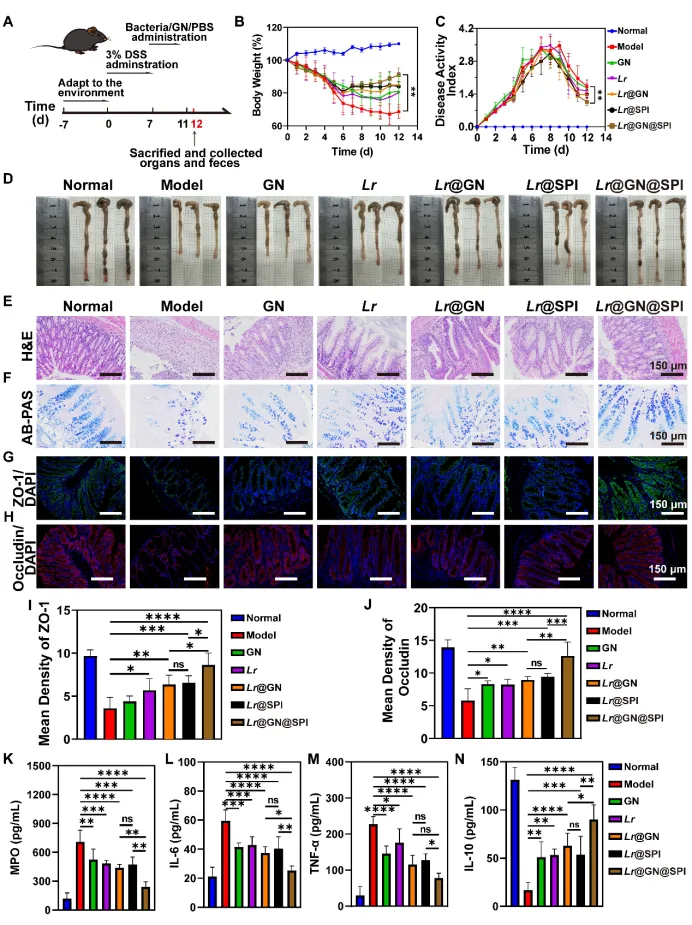
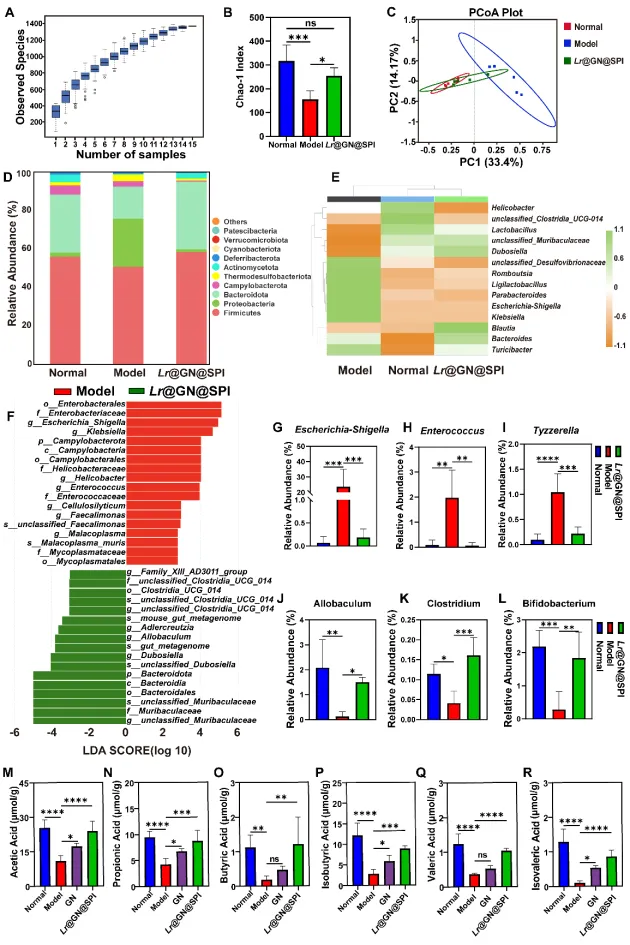
图6 分析 Lr@GN@SPI 治疗DSS诱导的UC小鼠的核心机制
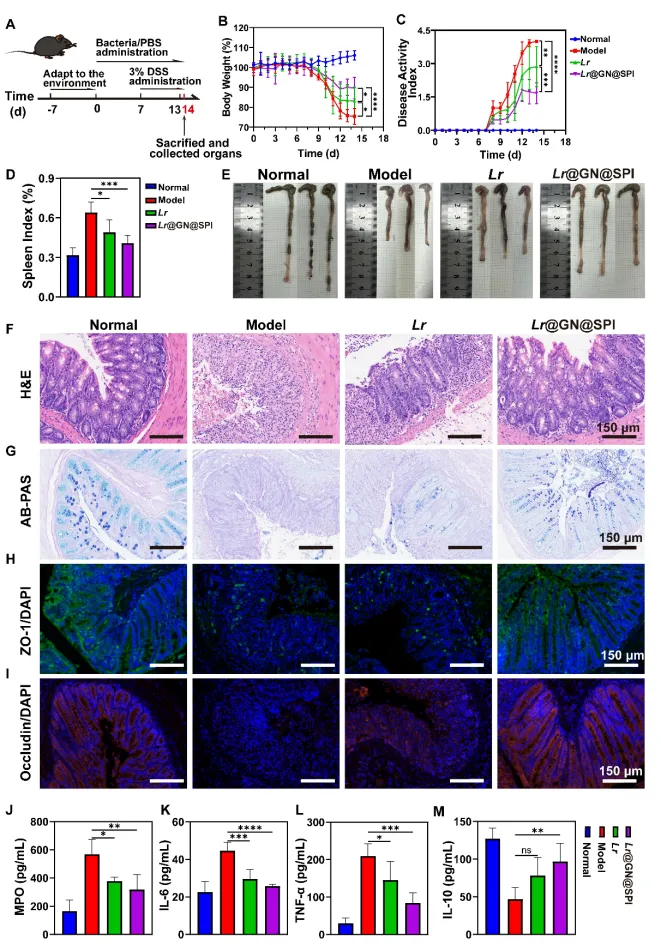
图7 Lr@GN@SPI对DSS诱导的UC的小鼠预防效果评价

(请点击标题查看)
分子对接与分子动力学黄酮类化合物
食品感官科学与分析农产品贮藏与加工
肉与肉制品蛋与蛋制品水产品
奶及奶制品豆及豆制品果蔬及果蔬制品
大米及米制品
炎症性肠病糖尿病肝病神经疾病
(请点击标题查看)
(请点击学者姓名查看)


在线投稿平台链接:https://www.wjx.top/jq/85151447.aspx
标注‘原创’仅代表原创编译,本平台不主张对原文的版权。本平台转载仅仅是出于学术交流和传播信息的需要,并不意味着代表本平台观点或证实其内容的真实性;转载文章版权归原作者所有,作者如果不希望被转载或有侵权行为,请联系本平台删除。由于编译水平有限,推文或简历有不妥之处,深感抱歉,请联系本平台修改或者删除。
